2020年,国家药品监督管理局以习近平新时代中国特色社会主义思想为指导,坚持以人民为中心的发展思想,严格落实“最严谨的标准”要求,统筹推进疫情防控和监管工作,大力推动医疗器械标准化各项工作,为医疗器械高质量发展提供坚强有力的保障。
一、疫情防控标准研究情况
(一)紧急研制疫情防控相关重点标准
紧急组织制定YY/T 1799-2020《可重复使用医用防护服技术要求》,及时公开标准文本。组织申报新冠病毒核酸检测试剂和高流量呼吸治疗设备专用安全等疫情防控相关6项国家标准立项,正按计划制定。组织紧急制定《医用防护口罩技术要求》《医用一次性防护服技术要求》《心肺转流系统 热交换水箱》《心肺转流系统 滚压式血泵》《气囊式体外反搏装置》《一次性使用静脉输液针》6项疫情防控重点医疗物资国家标准英文版。
(二)积极申请疫情防控国际标准立项
在申报国家标准立项的基础上,组织同步申报新冠病毒核酸检测试剂和高流量呼吸治疗设备专用安全等疫情防控相关国际标准立项。其中《医用电气设备 第2-90部分 高流量呼吸治疗设备基本安全和基本性能》项目,国际电工委员会(IEC)和国际标准化组织(ISO)分别以94.4%和94.7%支持率高票获得通过,并由中国专家担任该项目负责人,这是由我国提出并成功立项的首个新冠疫情防控相关医疗器械国际标准项目。
(三)全力做好疫情防控标准技术支撑
1. 开展疫情防控医疗器械国内外标准比对。紧急组织开展医用防护口罩、医用防护服、重症呼吸机、体外膜肺氧合器(ECMO)等26种抗“疫”急需的重点保障医疗器械国内外标准关键技术指标对比分析。
2. 组织开展医用防护产品应急灭菌技术研究。组织起草《医用一次性防护服辐照灭菌应急规范(临时)》《医用防护用品环氧乙烷灭菌后加速解析应急参考方法(临时)》,有效缩短了应急情况下医用防护服、医用口罩等投入使用的时间。
3. 积极组织开展新冠疫情防控科研攻关。组织协调开展国家“新型冠状病毒感染的肺炎疫情应急项目”专项中“医用防护服技术研究和产品开发评价”课题研究。
二、医疗器械标准体系情况
(一)明确医疗器械强制性行业标准定位
2020年7月7日,国家药监局印发《关于进一步加强医疗器械强制性行业标准管理有关事项的通知》(药监综械注〔2020〕72号),明确了进一步维护医疗器械强制性行业标准的法律地位,以及进一步优化标准体系等具体要求。
(二)开展“十四五”规划前期研究
组织各单位在“十四五”药品安全规划的大框架下,结合医疗器械标准各技术领域产业发展和监管需求的实际,认真研究“十四五”时期医疗器械标准规划。
(三)完善医疗器械标准关键环节管理程序
组织制定《医疗器械行业标准立项原则(试行)》《医疗器械国际标准化相关工作流程》,修订《医疗器械标准审核要点》,印发医疗器械国际标准转化原则及要求,提出医疗器械强制性标准制定新要求,进一步规范、完善医疗器械标准关键环节工作流程和要求。
三、“十三五”标准制修订任务完成情况
严格按照《医疗器械标准管理办法》《医疗器械标准制修订工作管理规范》要求,组织、指导医疗器械标准化(分)技术委员会或技术归口单位[以下统称标委会(技术归口单位)]按时保质完成医疗器械标准制修订任务。
2020年下达医疗器械国家标准制修订计划27项,医疗器械行业标准制修订计划87项;发布医疗器械国家标准24项,医疗器械行业标准125项,医疗器械行业标准修改单10项。截至2020年12月31日,医疗器械标准共计1758项(见表1),医疗器械标准体系持续优化。
《“十三五”国家药品安全规划》中500项医疗器械标准制修订任务已立项561项(见表2),超额完成12%,“十三五”医疗器械标准质量提升专项计划圆满收官。
表1. 医疗器械标准情况统计表
单位:项
强制性 | 推荐性 | 合计 | |
国家标准 | 92 | 134 | 226 |
行业标准 | 305 | 1227 | 1532 |
合计 | 397 | 1361 | 1758 |
表2.“十三五”医疗器械标准制修订情况统计表
单位:项
标准层级 | 年份 | 有源医疗器械 | 无源医疗器械和其他 | 体外诊断 | 合计 |
国家标准 | 2016 | 25 | 1 | 0 | 26 |
2017 | 0 | 3 | 0 | 3 | |
2018 | 9 | 15 | 4 | 28 | |
2019 | 0 | 5 | 1 | 6 | |
2020 | 6 | 8 | 13 | 27 | |
行业标准 | 2016 | 47 | 40 | 19 | 106 |
2017 | 22 | 54 | 10 | 86 | |
2018 | 42 | 45 | 12 | 99 | |
2019 | 35 | 46 | 12 | 93 | |
2020 | 34 | 36 | 17 | 87 | |
合计 | 220 | 253 | 88 | 561 | |
目标值 | 200 | 220 | 80 | 500 | |
完成率 | 110% | 115% | 110% | 112% | |
(一)标准数量大幅提升
“十五”“十一五”和“十二五”期间分别发布医疗器械标准292项、553项和476项。“十三五”期间,已发布医疗器械标准总数为710项,较“十二五”期间增长了49%,其中国家标准发布数量减少了15%,行业标准发布数量增长了59%。2020年共发布医疗器械标准149项,标准发布数量较上一年度增长了93%。自2001年“十五”实施以来医疗器械标准发布数量大幅提升(见图1)。
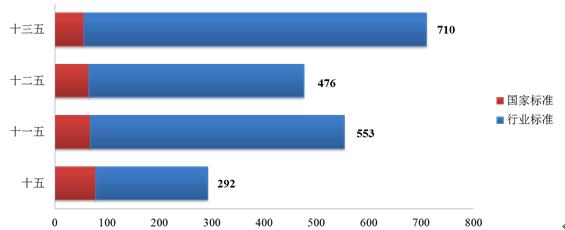
图1. 4个“五年计划”期间医疗器械标准发布数量统计图
(二)标准结构组成更加合理
截至2020年12月31日,按标准规范对象统计,现行有效的医疗器械标准中基础标准286项,占比16%;管理标准54项,占比3%;方法标准422项,占比24%;产品标准996项,占比57%。
2020年发布的149项标准中,基础标准27项、管理标准6项、方法标准30项、产品标准86项,基础标准占全年发布标准比例逐年增高,由2018年的5%增长到18%,医疗器械标准体系结构组成更趋合理(见图2)。
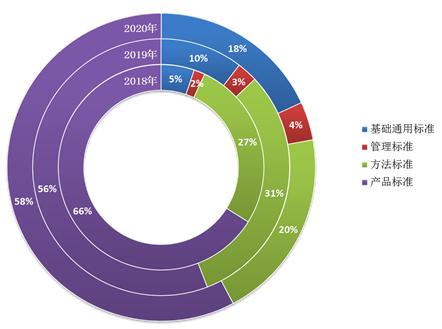
图2. 2018年—2020年发布医疗器械标准类别占比情况统计图
(三)标准领域覆盖更加全面
截至2020年12月31日,按标准规范对象统计,现行有效的医疗器械标准按照《中国标准文献分类法》,主要归类在医疗器械综合(C30)至医用卫生用品(C48)之间,占比前5位的分别是:医用化验设备(C44)14%,一般与显微外科器械(C31)11%,矫形外科、骨科器械(C35)11%,口腔科器械、设备与材料(C33)10%,医用射线设备(C43)9%(见图3)。医疗器械标准基本覆盖医用电气设备、手术器械、外科植入物等医疗器械各技术领域。
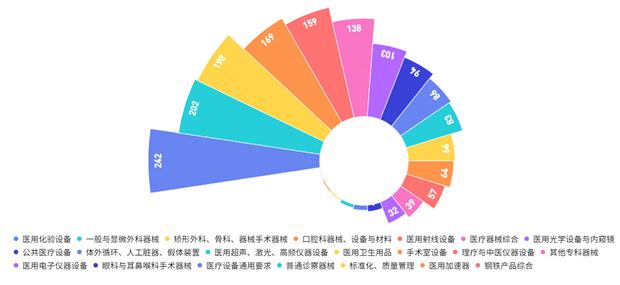
图3. 医疗器械标准各领域覆盖情况统计图(文献分类法)
(四)标准约束力更加优化
按照《强制性国家标准管理办法》《关于进一步加强医疗器械强制性行业标准管理有关事项的通知》要求,进一步优化完善医疗器械强制性国家标准和强制性行业标准体系。经协调,2项医用光学领域医疗器械强制性标准由工业和信息化部调整到国家药品监督管理局。
截至2020年12月31日,现行有效的医疗器械强制性标准共397项,占比23%。其中强制性国家标准92项,行业标准305项。397项医疗器械强制性标准中基础通用标准 106项(占27%)、方法标准 2项(1%)、产品标准 289 项(72%)。基础通用标准主要涉及产品通用安全和技术要求等方面;1项方法标准在2020年通过实施评价后拟整合修订为医疗器械推荐性行业标准。2016年至2020年发布医疗器械强制性标准统计情况见图4。
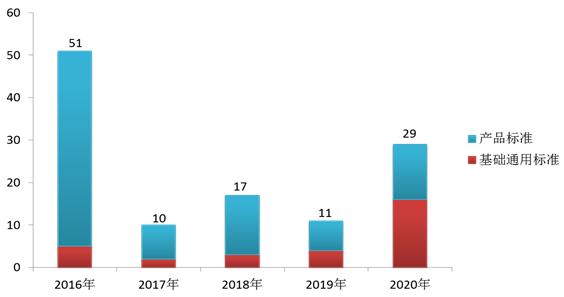
图4. “十三五”期间医疗器械强制性标准发布情况统计图
(五)医用电气设备安全标准发布实施
2020年4月,新版GB 9706.1-2020《医用电气设备 第1部分:基本安全和基本性能的通用要求》正式发布,将于2023年5月1日实施,是医用电气设备需要遵循的基础通用安全标准。该标准及其并列、专用标准均采用IEC 60601系列国际标准,其中适于转化的IEC 60601系列标准共74项。国家药品监督管理局组织制定了一揽子标准转化、编号、宣贯方案,有序推进系列标准转化。截至2020年12月31日,已发布15项标准,39项已完成制修订正在标准审核及出版社审校阶段,15项正在制修订中,需新转化制定的5项专用安全标准正在申请国家标准立项。
四、标准组织架构建设情况
2020年,国家药品监督管理局批准成立医用机器人标准化技术归口单位,批准筹建的全国医疗器械临床评价质量管理和通用要求标准化技术归口单位正按程序推进中。自1980年第一个医疗器械标委会成立以来,标委会(技术归口单位)数量已增长到33个(见图5),包括13个总标委会(TC)、13个分标委会(SC)和7个技术归口单位。医疗器械标准组织架构见图6。
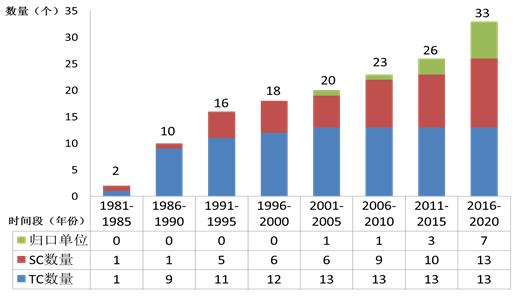
图5. 1981年-2020年医疗器械标委会及技术归口单位数量增长图
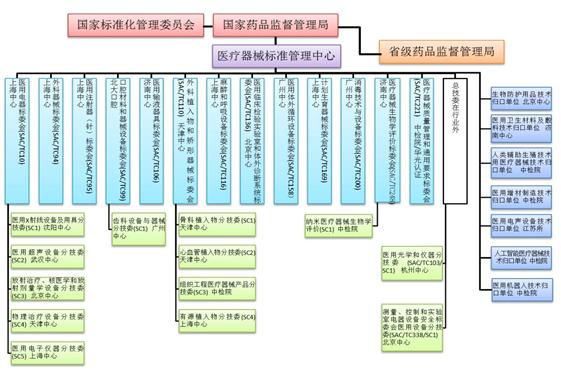
图6. 医疗器械标准组织架构图
五、标准精细化管理情况
(一)梳理医疗器械标准现状
探索性开展医保目录和一类医疗器械产品标准覆盖情况调研,为医疗器械标准立项奠定基础。组织对2009年12月31日前发布的86项医疗器械强制性标准开展标准实施评价,组织研提各技术领域医疗器械强制性标准制定原则,系统梳理存量医疗器械强制性标准,研提5年修订计划。
(二)建立国内外标准差异分析比对长效机制
加强医疗器械标准国内外比对基础性研究,明确在标准立项阶段要提供与国际、国外区域或欧、美、日等国家标准的初步对比分析报告;在标准报批阶段要就标准的重要技术指标和对应的试验方法与国际、国外标准的差异进行对比分析,并提供技术差异对比表,扎实做好医疗器械国内外标准差异分析技术储备。
(三)强化标准宣贯培训
制定并对外公布2020年医疗器械标准宣贯培训,组织召开医疗器械标准综合知识线上培训班,加强重要基础通用标准宣贯解读,在全国医疗器械安全宣传周期间举办GB 9706.1-2020《医用电气设备 第1部分 基本安全和基本性能的通用要求》免费网络培训公开课,共5900余人参训,进一步统一对该标准的理解。
六、参与国际标准制修订情况
(一)积极研提国际标准新项目
2020年共提出《医用输液器 第15部分:避光输液器》《组织工程医疗产品-脱细胞基质支架材料的残留DNA定量检测方法》等9项医疗器械国际标准立项申请,其中1项已成功立项,2项已通过成员国同意,进入项目立项(NP)投票阶段。
(二)有序推进国际标准制修订
推动由我国主导或牵头的8项医疗器械国际标准制定,其中由我国提出并成功立项的首个新冠疫情防控相关医疗器械国际标准项目已结束国际标准草案(DIS)投票;《心血管植入物-心脏封堵器》《医用输液器 第15部分:避光输液器》等2项国际标准项目已通过了委员会草案(CD)阶段投票,进入到DIS投票阶段;《组织工程医疗产品 软骨核磁评价 第1部分:采用dGEMRIC 和 T2 Mapping技术的临床评价方法》由技术报告(TR)调整为技术规范(TS),项目立项(NP)投票阶段获得成员国一致同意,进入工作组草案(WD)讨论阶段。
(三)鼓励积极参与国际标准化活动
组织参加国际标准化会议20余次,及时跟踪国际标准新动态,代表我国参与国际标准投票共计150余次。
七、标准信息公开情况
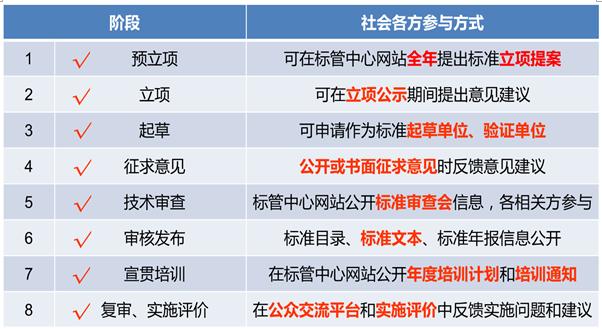
2020年,在国家药品监督管理局医疗器械标准管理中心(以下简称标管中心)网站对外公开322项医疗器械强制性标准文本和808项非采标推荐性标准文本,公开率均为100%。对外公开征求182项医疗器械标准立项项目和125项标准征求意见稿及编制说明意见,公开时间分别为1个月和2个月。对外公开了94项各标委会(技术归口单位)医疗器械标准项目征集、委员征集、标准审定会等相关信息,鼓励各方积极参与医疗器械标准制修订工作。及时公布2020年度医疗器械标准宣贯计划,加大标准宣贯的力度。对从标管中心公众反馈平台反馈的137项意见建议及时进行答复处理。建立了各相关方广泛参与医疗器械标准制修订全过程的机制(见表3)。
表3. 医疗器械标准制修订全过程参与方式一览表
国家药品监督管理局医疗器械注册管理司
国家药品监督管理局医疗器械标准管理中心
2021年2月5日


