国家标准化指导性技术文件GB/Z 44877—2024《医疗器械灭菌 环氧乙烷灭菌过程参数放行指南》由全国消毒技术与设备标准化技术委员会归口管理,于2024年10月26日发布,2026年11月1日实施。为便于标准的使用,现对该文件的定位、作用意义及相关技术内容进行解读。
一、GB/Z文件的定位和法律效力
根据行政规范性文件《国家标准化指导性技术文件管理规定》(2025年4月7日修订发布)第二条:国家标准化指导性技术文件(简称指导性技术文件)是指技术尚在发展中,需要引导其发展或者具有标准化价值的项目,通过标准化活动,按照规定程序制定供有关各方参考使用的标准化文件。第九条明确指出:指导性技术文件不具有强制性。
GB/Z 44877—2024修改采用ISO/TS 21387:2020《医疗器械灭菌 环氧乙烷灭菌采用参数放行确认和常规处理要求的指南》,提供了符合GB 18279中关于参数放行的途径和方法指南,GB/Z 44877的制定,是和国际标准的接轨,也是新冠疫情期间遇到急救防护物资短缺而提出应对技术方案,同时也能为国内无菌医疗器械生产企业出口产品采用环氧乙烷灭菌参数放行提供更好的指导。
二、环氧乙烷灭菌相关标准和产品灭菌放行要求
医疗器械环氧乙烷灭菌现行有效的标准主要为GB 18279.1—2015《医疗保健产品灭菌 环氧乙烷 第1部分:医疗器械灭菌过程的开发、确认和常规控制的要求》和GB/T 18279.2—2015《医疗保健产品的灭菌 环氧乙烷 第2部分:GB 18279.1应用指南》;目前已经发布GB 18279—2023《医疗保健产品灭菌 环氧乙烷 医疗器械灭菌过程的开发、确认和常规控制要求》,将取代GB 18279.1—2015和GB/T 18279.2—2015,于2026年10月1日实施。GB 18279采用ISO 11135国际标准制定,规定了医疗器械产品在制造过程中环氧乙烷灭菌过程的开发、确认和常规控制要求,适用于采用环氧乙烷灭菌的医疗器械。主要技术内容包括:质量管理体系、灭菌因子特性、过程和设备特性、产品定义、过程定义、确认、常规监视和控制、产品的灭菌放行、保持灭菌过程有效性等九个方面。
GB 18279与ISO 11135国际标准的关系可见下图。
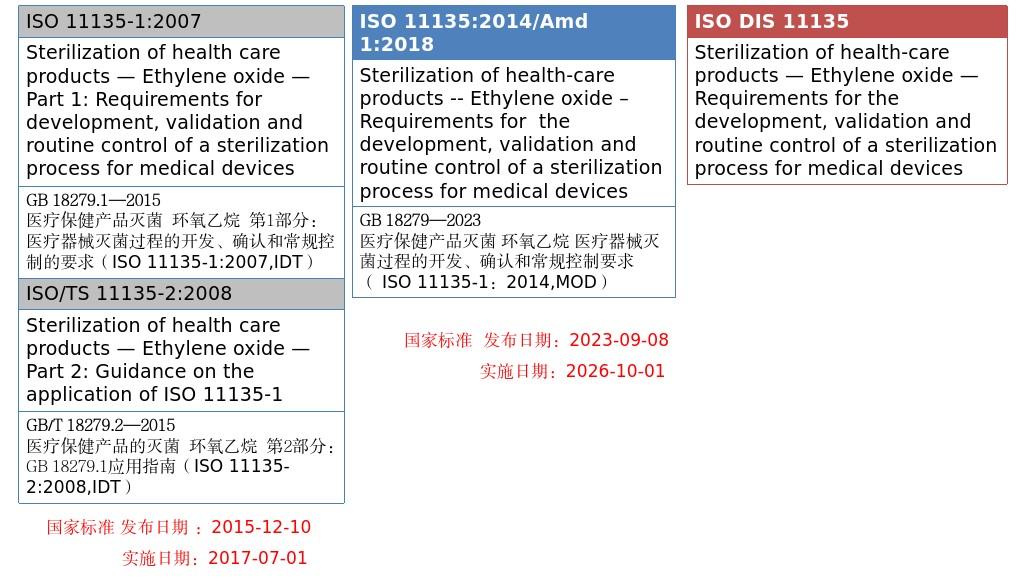
全国消毒技术与设备标准化技术委员会还制定了其他环氧乙烷灭菌相关标准与GB 18279配合使用,具体可见下表。
标准编号 | 标准名称 | 发布日期 | 实施日期 |
YY/T 1302.1—2015 | 环氧乙烷灭菌的物理和微生物性能要求 第1部分:物理要求 | 2015/3/2 | 2016/1/1 |
YY/T 1302.2—2015 | 环氧乙烷灭菌的物理和微生物性能要求 第2部分:微生物要求 | 2015/3/2 | 2016/1/1 |
YY/T 1267—2015 | 适用于环氧乙烷灭菌的医疗器械的材料评价 | 2015/3/2 | 2016/1/1 |
YY/T 1268—2023 | 环氧乙烷灭菌的产品追加和过程等效 | 2023/3/14 | 2024/5/1 |
YY 0503—2023 | 环氧乙烷灭菌器 | 2016/3/23 | 2018/1/1 |
YY/T 0822—2011 | 灭菌用环氧乙烷液化气体 | 2010/12/27 | 2013/6/1 |
YY/T 1403—2017 | 环氧乙烷分包灭菌的要求 | 2017/3/28 | 2018/4/1 |
YY/T 1544—2017 | 环氧乙烷灭菌安全性和有效性的基础保障要求 | 2017/5/2 | 2018/4/1 |
GB/Z 44877—2024 | 医疗器械灭菌 环氧乙烷灭菌过程参数放行指南 | 2024/10/26 | 2026/11/01 |
关于产品灭菌放行的要求,可见GB 18279.1—2015的第11章:

GB 18279—2023的第11章:

GB 18279—2023的D.11.1对11.1的要求进行了解释:

从11.1 的要求和D.11.1的解释,可以知道GB 18279对产品灭菌放行有两种规定方式:
1.传统放行(11.1的a)和b)均适用),通常俗称为“物理参数+生物指示物”放行;
2.参数放行(11.1的a)适用,b)不适用)。
这两种方式都是可接受的,但选择参数放行,需要得到批准。
GB 18279自2000年发布以来,与国际标准保持一致,允许采用两种方式进行灭菌放行。见GB 18279—2000的第7章是包括传统的产品放行和参数放行两种方式:

![]()
如上述,GB 18279允许传统放行和参数放行两种方式,标准中没有规定参数放行的具体技术要求,GB/Z 44877—2024提供了符合GB 18279中关于参数放行的途径和方法指南。
GB/Z 44877的实施,相对于传统放行方式,提出了更多的要求:
1.设备硬件的更多要求:譬如两个不同位置的温度传感器;直接监测湿度的湿度传感器;直接监测环氧乙烷浓度的浓度传感器;预处理室(如使用)、灭菌器、解析室(如使用)需要增加空气内循环系统。隐含的设备要求还有:湿度传感器的校准系统;浓度传感器的校准系统。
2.管理上的更多要求:对温度、环氧乙烷浓度、压力、湿度需要进行在线校准;温度和压力推荐一年进行一次校准;环氧乙烷浓度推荐每6个月进行一次校准;直接接触环氧乙烷的湿度传感器(如电子传感器)推荐每周进行一次校准;湿度传感器如不直接接触环氧乙烷,推荐每6个月进行一次校准。灭菌器的安装鉴定(IQ)和运行鉴定(OQ)由于新增加了仪表和附属设施,因此需要针对这些增加的项目进行IQ和OQ,需要对两只温度的传感器的偏差进行定义。灭菌确认的PQ过程也增加了要求,当按照传统放行的方法完成PQ过程后,还需要至少采用这个确认的过程规范完成至少30批次的常规灭菌,30次灭菌期间,产品采用传统放行,然后制造商需要对这30批次的数据进行统计分析,以确定参数放行的规范(湿度和浓度上下限的建立)。
3.过程维护的更多要求:需要每年对灭菌数据进行统计分析,另外再鉴定也比传统放行有更高的频率(从2年一次提高到1年一次)。
三、GB/Z 44877与医疗器械生产质量管理规范的关系
《医疗器械生产质量管理规范》(2014年第64号)定义了特殊过程:指通过检验和试验难以准确评定其质量的过程。而灭菌就是这样的一个特殊过程。
《医疗器械生产质量管理规范附录无菌医疗器械》(2015年第101号)中规定:2.4.1 生产企业灭菌的,应当明确灭菌工艺(方法和参数)和无菌保证水平(SAL),并提供灭菌确认报告。2.6.8 应当选择适宜的方法对产品进行灭菌或采用适宜的无菌加工技术以保证产品无菌,并执行相关法规和标准的要求。2.6.9 应当建立无菌医疗器械灭菌过程确认程序并形成文件。灭菌过程应当按照相关标准要求在初次实施前进行确认,必要时再确认,并保持灭菌过程确认记录。GB 18279就是医疗器械环氧乙烷灭菌确认的相关标准,而GB/Z 44877是GB 18279中产品灭菌放行要求的补充和完善。
《医疗器械生产质量管理规范》(2014年第64号)第五十八条规定:企业应当根据强制性标准以及经注册或者备案的产品技术要求制定产品的检验规程,并出具相应的检验报告或者证书。
《医疗器械生产企业质量控制与成品放行指南的通告》(2016年第173号)成品检验与成品放行中规定:成品检验规程的内容原则上应当覆盖已注册或者备案的产品技术要求中需要常规控制的检验项目和检验方法。不能覆盖的,应当在成品检验规程中予以说明。必要时,应当给出经过确认的替代解决方案。
在实际监管中,考虑到国内各企业生产质量管理水平层次不齐、医疗器械产品种类复杂、对灭菌确认理解不同和执行差异、参考药品生产质量管理规范和药典要求等多方面原因,监管部门要求无菌医疗器械生产企业按照产品技术要求,在成品放行中要求进行“无菌检查”的检验项目。医疗器械的科学监管需要考虑法规要求、生产企业的质量管理体系运行情况、监管人员的能力等多种因素,GB/Z 44877标准的执行和实施不能偏离监管的要求。


